Krystaliczna woda
Dobrym sposobem ustalenia możliwych struktur jest rozpoczęcie od szukania precedensu. Jeśli strefa zamknięta wynika z uporządkowania wody, to logiczne podejście sugeruje przyjrzenie się znanym uporządkowanym strukturom wodnym.
Może któryś wariant tych struktur okaże się odpowiedni. Ostatecznie uznaliśmy, że najwłaściwszym wyborem będzie lód. Lód ma dobrze znaną uporządkowaną strukturę. Ponadto charakteryzuje się wykluczaniem – kiedy narasta, wypycha molekuły i cząsteczki, tworząc kryształy w dużej mierze wolne od zanieczyszczeń. Czyżby struktura lodu mogła stanowić klucz do struktury EZ?
Płaszczyzny (standardowego) lodu ułożone są z sześciokątnych struktur (patrz rysunek 3). Powtarzające się sześciokątne układy tworzą arkusz o wyglądzie plastra miodu zbudowanego z tlenu i wodoru. Protony (szkic dolny) łączą każdą płaszczyznę z płaszczyznami leżącymi powyżej i poniżej. Te protony wiążą atomy tlenu, tworząc sztywną strukturę lodu. Tylko co drugi atom tlenu jest związany; pozostałe, jako elektroujemne, odpychają się wzajemnie, tworząc niewielkie sfałdowania widoczne w każdej płaszczyźnie.
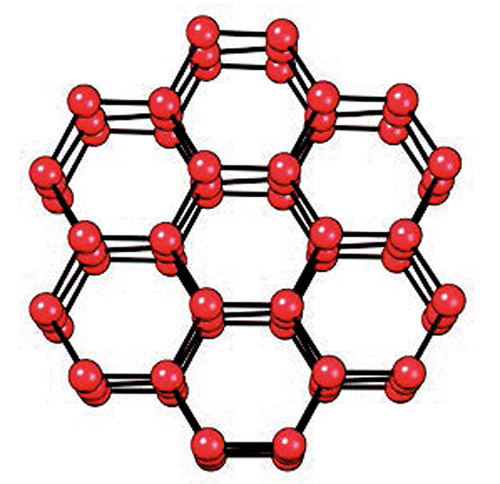
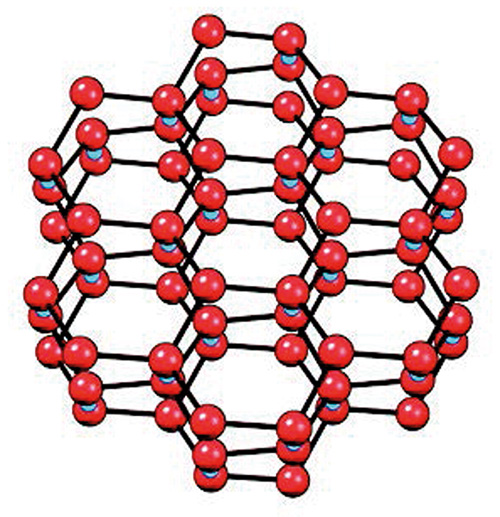
Rys. 3. Strukturalny model pospolitego lodu widziany pod różnymi kątami. Atomy tlenu są czerwone. Atomy wodoru (nie pokazane) leżą w połowie linii łączących atomy tlenu. Międzypłaszczyznowe protony (niebieskie na dolnym rysunku) łączą atomy tlenu. Wiązania tworzą fałdy, co sprawia, że układ atomów wydaje się mniej płaski i bardziej czworościenny.
Z drugiej strony, obszar zamknięcia nie jest sztywny i zachowuje się jak lepki płyn, a to oznacza, że struktura lodu w niewystarczający sposób odwzorowuje strukturę EZ. Niewielka korekta struktury lodu zaowocowała potencjalnym kandydatem na EZ. Właściwa struktura EZ wymaga pewnej płynności, zaś płyny czerpią swoją płynność z tego, że ich warstwy składowe mogą ślizgać się po sobie. Tak więc w przypadku strefy zamkniętej warto rozważyć model stosu przypominających lód płaszczyzn pozbawionych międzypłaszczyznowych protonowych usztywniających wiązań. Bez tych wiązań płaszczyzny mogłyby przesuwać się względem siebie, zapewniając wymaganą półpłynność. Model ten wydawał się obiecujący.
Poliwoda raz jeszcze
Model poliwody, podobny do struktury przypominającej lód, którą rozważaliśmy, zakłada istnienie stosu arkuszy plastra miodu zbudowanych z atomów wodoru i tlenu.
W artykule opublikowanym w roku 1969 w szanowanym czasopiśmie Science E.R. Lippincott i współpracujący z nim chemicy z Uniwersytetu Maryland przedstawili hipotetyczną molekularną strukturę poliwody,6 która się nie przyjęła. Ze względu na zdyskredytowanie poliwody zaledwie kilka miesięcy po publikacji tego modelu nikt nie zadał sobie trudu, aby go dogłębnie przeanalizować. W rezultacie wszelkie próby zbadania natury poliwody szybko odłożono do lamusa.
Lippincott i jego współpracownicy wyizolowali z szerokiego zbioru zgromadzonych danych fizykochemicznych strukturę plastra miodu. Dane dotyczyły widm Ramana, ekstremalnego zamarzania i wrzenia oraz wysokiej gęstości. Konstrukcja przedstawiona na rysunku 4 najlepiej pasuje do danych doświadczalnych.
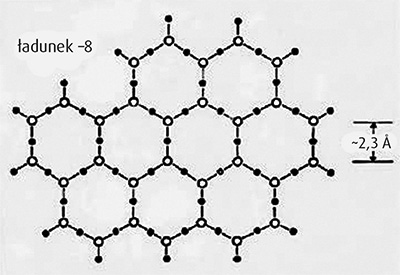
Rys. 4. Struktura molekularna poliwody zaproponowana przez Lippincotta i kolegów. Cząsteczki tlenu reprezentują otwarte okręgi, zaś wodoru okręgi zaczernione. Arkusze układają się w stos, co daje strukturę objętościową.
Kilka spraw zawartych w wspomnianym artykule odbiło się szerokim echem. Po pierwsze, artykuł przypomniał mi, że natura lubi struktury sześciokątne. Można obserwować je w całej chemii organicznej. Można również zobaczyć tę strukturę w graficie, gdzie składowe arkusze w kształcie plastrów miodu (grafen) mogą łatwo ślizgać się po sobie z powodu niskiego tarcia. Pospolicie występujące sześciokątne arkusze wydają się naturalną opcją wartą uwagi.
Po drugie, autorzy prowokacyjnie oświadczyli, że rzeczona substancja nie jest wodą. Ta substancja jest rzeczywiście zbudowana z tlenu i wodoru, ale ich rozmieszczenie w formie sześciokątnej siatki w niewielkim stopniu przypomina ich rozmieszczenie w cząsteczce wody. Twierdzą, że ta nowa substancja „nie powinna być uważana za wodę ani nawet nazywana wodą, analogicznie jak w wypadku właściwości polimeru etylenu [polietylenu], które nie pokrywają się z właściwościami etylenu”. Autorzy uznali za oczywiste, że ta substancja chemicznie wyraźnie różni się od wody.
Trzecią cechą, która naprawdę zwróciła moją uwagę i zmusiła do zastanowienia, był stosunek atomów wodoru do atomów tlenu. Jak wiadomo, stosunek ilościowy tych atomów w zwykłej wodzie wynosi 2:1. W tej płaskiej strukturze ich stosunek wynosi 3:2. Ta cecha nie od razu rzuca się w oczy. Rysunek 5 przedstawia uproszczoną metodę weryfikacji tego stosunku.
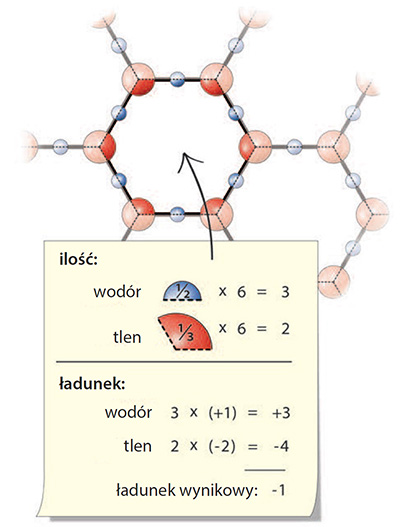
Rys. 5. Obliczanie ładunku netto każdej sześciokątnej jednostki. Aby wykonać obliczenie, należy przedstawić każdy atom jako warstwowy tort, następnie policzyć wszystkie frakcje tortu leżące w danym sześciokącie, mając na względzie to, że ładunek tortu tlenowego wynosi –2 a wodorowego +1. Wynikowy stosunek wodoru do tlenu wynosi 3:2, a ładunek netto sześciokąta –1.